研究材料
AOM-DSS模型鼠、AOM-DSS+Hhep小鼠
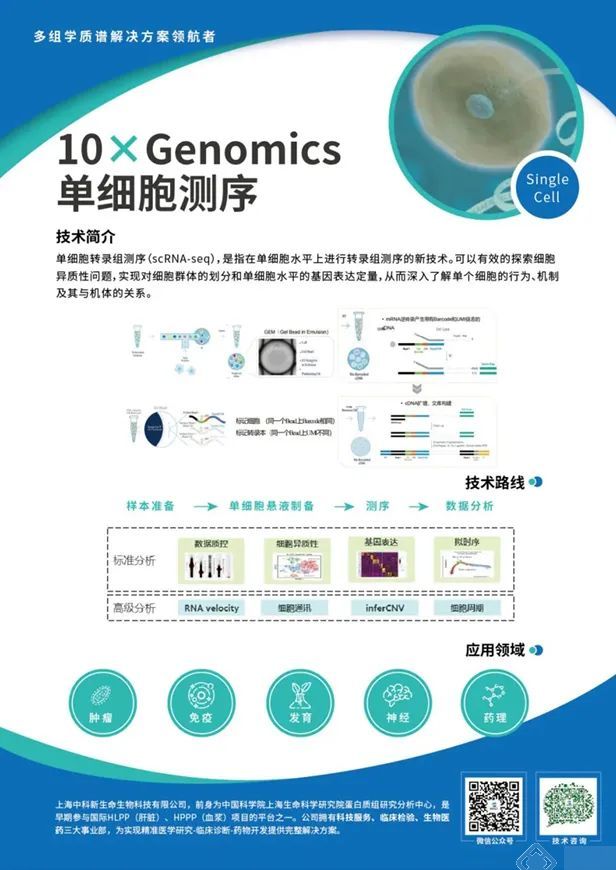
技术路线
· 步骤1:表型数据分析发现Hhep定殖介导了结肠癌中强大的抗肿瘤作用;
· 步骤2:单细胞转录组分析揭示Hhep定殖增加细胞毒性淋巴细胞的肿瘤浸润并促使TLSs的扩张;
· 步骤3:Tfh 细胞是 Hhep 介导的肿瘤控制和免疫浸润所必需的。
研究结果
1. Hhep定殖重塑结直肠癌肿瘤微环境
前人的研究表明,Hhep菌(一种具有内在免疫原性的肠道细菌)定殖荷瘤小鼠引发的特异性免疫反应可修饰结肠癌微生物群结构,导致抗肿瘤免疫增强。本研究,作者将Hhep菌定殖于生长7周的结直肠癌(CRC)小鼠模型中,相对于对照组(荷瘤小鼠无Hhep菌定殖),Hhep定殖显著减少了肿瘤的数量和大小,延长了小鼠的生存周期。同时,Hhep定殖对肿瘤小鼠的肠道微生物群产生影响,以及肿瘤的免疫细胞浸润增加。以上结果表明,Hhep定殖介导了结肠癌中强大的抗肿瘤作用。

图1 Hhep可降低肿瘤负荷并增加CRC的生存周期
2. Hhep驱动的抗肿瘤免疫
为了更全面的了解Hhep定殖对CRC TME的影响,作者对肿瘤上皮层细胞(epithelial layer,EL)进行单细胞转录组测序,共鉴定出12个细胞簇,Hhep定殖诱导了细胞毒性淋巴细胞(簇1)和效应T细胞(簇5)的增加。其中细胞毒性淋巴细胞包含多种不同的NK细胞和T细胞(CD8+、CD4+),表达与细胞毒性功能相关的基因(Gzma)。以上数据表明,Hhep定殖增加细胞毒性淋巴细胞的肿瘤浸润。

图2 Hhep定殖导致肿瘤TME的细胞毒性淋巴细胞的增加
3. Hhep定殖促使TLSs扩张
前人的研究表明,Hhep特异性CD4+T细胞主要在结肠固有层( lamina propria,LP)中积累(Chai et al., 2017; Xu et al., 2018),因此作者利用单细胞转录组测序分析了Hhep定殖对LP的影响。聚类分析揭示了表达与基质和内皮细胞相关基因的细胞(簇 1、5、9 和 13)的富集,特别是 Hhep 定殖小鼠中 Ccl21a+Lyve1+ 淋巴管簇(簇 9、子簇 2)的增加。同时,作者观察到 LP 中淋巴管生成所需基因(Pdpn,Vegfc)的频率增加,荧光显微镜显示 Lyve-1 染色增加。Hhep定殖的小鼠显示肿瘤周围和肿瘤内部的TLSs数量增加,与TLS形成相关的基因表达增加,以上数据表明,Hhep 定殖促使小鼠结肠淋巴网络的扩张。

图3 Hhep定殖扩大了结肠淋巴网络
4. Hhep定殖驱动Hhep特异性CD4+Tfh细胞扩增
抗体介导的耗竭实验显示,抗肿瘤免疫不依赖于CD8+T细胞,但依赖于CD4+T细胞。因此,作者分析了结肠中CD4+T细胞对Hhep定殖的反应,流式结果显示,在Hhep定殖后,CD4+ T细胞中Tfh细胞(CXCR5+PD1+CD4+ T cells)的百分比持续增加,即在结直肠肿瘤的背景下,Hhep定殖驱动Hhep特异性Tfh细胞扩增。

图4 Hhep定殖驱动Hhep特异性Tfh细胞扩增
5. Tfh细胞是Hhep菌介导的肿瘤控制和免疫浸润所必需的
对TLSs进行FISH染色发现TLSs中含有Hhep菌和Hhep特异性T细胞。为了测试Hhep特异性Tfh细胞在TLS诱导和直接控制CRC中的重要性,作者利用AOM-DSS+Hhep处理Bcl6fl/flCd4Cre小鼠(Tfh 细胞缺陷型)诱导CRC证实了Tfh细胞是Hhep驱动的结肠TLS形成、肿瘤的免疫浸润和控制肿瘤生长所必需的。所有数据表明,在CRC动物模型中,Hhep特异性Tfh细胞足以驱动TLS形成、增加免疫浸润并导致肿瘤减少或清除。癌症基因组图谱 (TCGA) 数据库中对CRC患者的分析表明,丰富的Tfh细胞特征通常存在于处于较低肿瘤阶段的患者体内,并且还与更长的无进展生存期相关,因此,在小鼠和人类患者中,Tfh细胞和TLS的存在与更好地控制CRC相关。

图5 Tfh细胞是Hhep菌介导的肿瘤控制和免疫浸润所必需的
小编小结
综上,本文利用最新的单细胞转录组技术联合肠道微生物测序技术,揭示了肝螺杆菌增强了适应性免疫反应,并促使辅助T细胞和产生抗体的B细胞的选择性激活,小鼠结肠肿瘤缩小,延长了小鼠的生存周期。这项开创性研究为利用肠道微生物群治疗(对常规药物和免疫疗法耐药的)结直肠癌肿瘤提供了强有力的证据。
中科优品推荐
【中科新生命】重点布局单细胞多组学平台,先后建立了基于10x Genomics 最新Chromium X的单细胞转录组测序平台以及“一站式”单细胞蛋白质组服务平台。其中,Chromium X作为当前业内通量最高的单细胞测序平台之一,可以实现百万级细胞通量检测,为大规模单细胞图谱、高通量药物筛选、稀有细胞鉴定分析等需求提供助力。