什么是细胞因子?
细胞因子(Cytokine)是一类能在细胞间传递信息,具有免疫调节和效应功能的低分子量蛋白质或小分子多肽。细胞因子在体内含量极少,但几乎影响所有生物过程,包括胚胎发育、疾病发病机制、对感染的非特异性反应、对抗原的特异性反应等,他们在感染、肿瘤、造血功能障碍、自身免疫性疾病等诊断和治疗领域具有十分重要的作用。
细胞因子的基本特征
细胞因子大多是可溶性多肽,通常为糖蛋白。它们高效且数量较少,一般在pmol/L级别。细胞因子必须与细胞因子受体结合才能发挥作用。这些分子可诱导产生,合成后具有自限制性,并且半衰期短,效应范围小。绝大多数细胞因子近距离发挥作用。
细胞因子的作用方式
自分泌(Autocrine):自分泌是指细胞释放的信号分子影响同一类型的细胞。简而言之,细胞释放的物质会影响到自身。这种信号传导通常发生在局部,影响到释放信号的细胞附近的细胞。
旁分泌(Paracrine):旁分泌是指细胞释放的信号分子影响到邻近的细胞。与自分泌不同,这种信号传导作用于相邻但不同类型的细胞。
内分泌(Endocrine):内分泌系统是一种生理系统,通过激素的分泌直接将信号传达到身体各处,以调节生理过程。内分泌系统的激素通过血液输送到目标器官,影响远处的细胞和组织。
细胞因子的功能特点
多效性:一种细胞因子作用于不同的靶细胞产生不同的生物效应。
重叠性:不同的细胞因子作用于同一靶细胞,产生相同或相似的生物学效应。
协同性:一种细胞因子可以增强另一种细胞因子的功能。
拮抗性:一种细胞因子抑制其他因子发挥作用。
网络型:免疫细胞通过不同细胞因子相互刺激、彼此约束形成网络。
细胞因子的分类
白细胞介素(Interleukin, IL-s)
早期发现的细胞因子都来源于白细胞,并参与白细胞间的信息沟通,故将它们统称为白细胞介素,后来发现除白细胞外其它细胞也可以产生白细胞介素,临床上常用于增强免疫力及抗感染抗肿瘤治疗。下面是主要的白细胞介素的产生细胞、靶细胞和主要作用。

上表中,与T细胞增殖、分化、活化相关的白细胞介素有IL-2、IL-12,促进Th0向Th1分化;与B细胞活化、抗体类别转换相关的白细胞介素有IL-4,促进Th0向Th2分化;与NK细胞增殖、活化相关的白细胞介素有IL-2、IL-12、IL-15。
干扰素(Interferon, IFN)
是具有抗病毒、抗肿瘤和免疫调节特性的多效性细胞因子,是免疫反应的中心协调剂。IFN主要有I型、II型和III型。I型IFN家族由14种IFN-α、IFN-β、IFN-κ、IFN-ω和IFN-ɛ组成,而II型IFN只有IFN-γ[1],III型IFN家族由四种细胞因子组成:IFN-λ1(IL-29)、IFN-λ2和IFN-λ3(分别为IL-28A和IL-28B)以及IFN-λ4[2]。下面是干扰素的类型以及主要功能。

肿瘤坏死因子超家族
(Tumor Necrosis Factor, TNF)
是一类细胞因子家族,包括多个成员,现在已经发现的肿瘤坏死因子超家族包括19个配体和29个不同的受体。TNF超家族的配体成员主要有NF-κB配体的TNF-α、TNF-β、淋巴毒素-β、CD40L、FasL、CD30L、4-1BBL、CD27L和OX40L,TNF相关凋亡诱导配体(TRAIL),LIGHT受体激活剂(RANKL),TNF相关的凋亡诱导因子(TWEAK),增殖诱导配体(APRIL),B细胞激活因子(BAFF),血管内皮细胞生长抑制剂(VEGI),胞质素A(EDA-A1,EDA-A2)和GITRL。TNF受体(TNFR)主要是跨膜蛋白,参与一些生理过程,如宿主防御、炎症、细胞凋亡、自身免疫、以及免疫、外胚层和神经系统的发育和器官发生等。肿瘤坏死因子TNF超家族成员与29个受体特异性识别,构成配体-受体作用系统,具体情况如图1所示[3]。
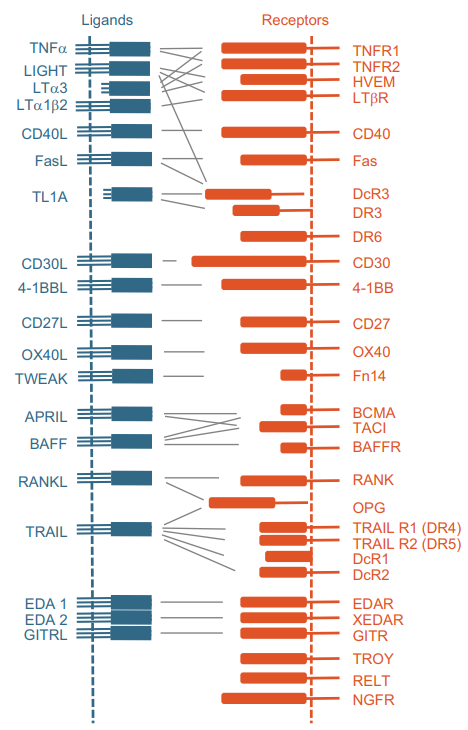
图1:肿瘤坏死因子配体(左)和TNF 受体(右)在两个独立但相互作用的细胞上表现为跨膜蛋白。垂直虚线代表这些细胞的质膜。
趋化因子(Chemokine)
对不同靶细胞具有趋化效应的细胞因子,趋化因子是8-12kDa的分泌蛋白,通过与Gαi蛋白偶联的七跨膜受体(Gαi-protein-coupled Seven-transmembrane-spanning Receptors, GPCR)结合来调节定向细胞迁移(趋化性),粘附,细胞定位和细胞间相互作用,即所谓的经典趋化因子受体。趋化因子还与非典型趋化因子受体(Atypical Chemokine Receptors, ACKRs)结合,这些受体也是七个跨膜受体,但不是G蛋白偶联,也不会诱导趋化性。趋化因子系统由近50个趋化因子配体、20个信号GPCR和4个ACKR组成,在发育、稳态、炎症、感染和病理过程(包括肿瘤发生)中起着重要作用[4]。下图是趋化因子及其受体的结合情况[5]。

图二:趋化因子及其受体结合情况:其中趋化因子受体使用CCR(绿色)、CXCR(红色)、XCR(橙色)或CX3CR(蓝色)表示。趋化因子用浅蓝色方框表示。
集落刺激因子
(Colony-Stimulating Factor, CSF)
能够刺激多能造血干细胞分化、增殖,并形成某一谱系细胞集落的细胞因子,是血细胞发生的重要刺激因子,根据集落刺激因子的作用范围,可以分为粒细胞CSF(G-CSF)、巨噬细胞CSF(M-CSF)、粒细胞和巨噬细胞CSF(GM-CSF)、多能集落刺激因子(multi-CSF;又称IL-3)、红细胞生成素(EPO)和血小板生成素(TPO)等[6]。

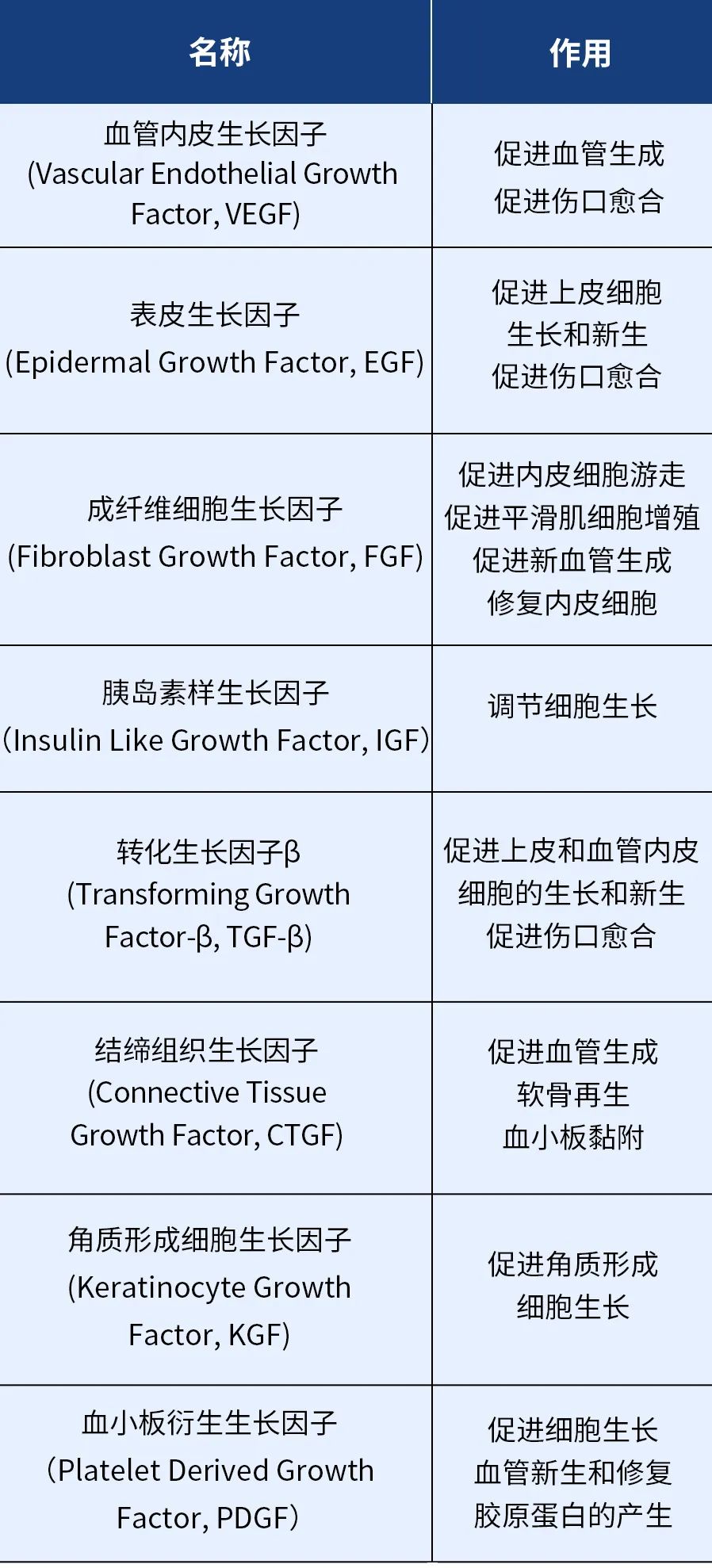
生长因子(Growth Factor, GF)
是一类通过与特异的、高亲和的细胞膜受体结合,调节细胞生长与其他细胞功能等多效应的多肽类物质。存在于血小板和各种成体与胚胎组织及大多数培养细胞中,对不同种类细胞具有一定的专一性。其分类和作用可以总结成下列表格:
WORK SUMMARY REPORT
相关ELISA试剂盒产品
|
产品货号 |
英文名称 |
中文名称 |
|
SEKH-0059 |
Human M-CSF |
人巨噬细胞集落 刺激因子 |
|
SEKM-0042 |
Mouse M-CSF |
小鼠巨噬细胞集落 刺激因子 |
|
SEKH-0057 |
Human GM-CSF |
人粒细胞巨噬细胞 集落刺激因子 |
|
SEKM-0041 |
Mouse GM-CSF |
小鼠粒细胞巨噬细胞 集落刺激因子 |
|
SEKR-0011 |
Rat GM-CSF |
大鼠粒细胞巨噬细胞 集落刺激因子 |
|
SEKH-0058 |
Human G-CSF |
人粒细胞 集落刺激因子 |
|
SEKM-0040 |
Mouse G-CSF |
小鼠粒细胞 集落刺激因子 |
|
SEKH-0010 |
Human IL-3 |
人白细胞介素3 |
|
SEKM-0201 |
Mouse IL-3 |
小鼠白细胞介素3 |
|
SEKH-0056 |
Human SCF |
人干 细胞因子 |
|
SEKM-0131 |
Mouse SCF |
小鼠干 细胞因子 |
|
SEKR-0029 |
Rat SCF |
大鼠干 细胞因子 |
|
SEKH-0161 |
Human Erythropoietin (EPO) |
人红细胞 生成素 |
|
SEKM-0157 |
Mouse Erythropoietin (EPO) |
小鼠红细胞 生成素 |
|
SEKH-0060 |
Human Thrombopoietin (Tpo) |
人血小板 生成素 |
|
SEKH-0227 |
Human LIF |
人白血病 抑制因子 |
|
SEKR-0153 |
Rat CD118/LIFR |
大鼠白血病抑制 因子受体 |
|
SEKH-0166 |
Human EPOR |
人红细胞生 成素受体 |
|
SEKH-0451 |
Human G-CSF R |
人粒细胞集落 刺激因子受体 |
参考文献
[1] Capobianchi, M. R.; Uleri, E.; Caglioti, C.; et al. Type I IFN family members: similarity, differences and interaction. Cytokine Growth Factor Rev 2015, 26 (2), 103-111. DOI: 10.1016/j.cytogfr.2014.10.011.
[2] Broggi, A.; Granucci, F.; Zanoni, I. Type III interferons: Balancing tissue tolerance and resistance to pathogen invasion. J Exp Med 2020, 217 (1). DOI: 10.1084/jem.20190295.
[3] Dostert, C.; Grusdat, M.; Letellier, E.; et al. The TNF Family of Ligands and Receptors: Communication Modules in the Immune System and Beyond. Physiol Rev 2019, 99 (1), 115-160. DOI: 10.1152/physrev.00045.2017.
[4] Märkl, F.; Huynh, D.; Endres, S.; et al. Utilizing chemokines in cancer immunotherapy. Trends Cancer 2022, 8 (8), 670-682. DOI: 10.1016/j.trecan.2022.04.001.
[5] Ozga, A. J.; Chow, M. T.; Luster, A. D. Chemokines and the immune response to cancer. Immunity 2021, 54 (5), 859-874. DOI: 10.1016/j.immuni.2021.01.012.
[6] Wicks, I. P.; Roberts, A. W. Targeting GM-CSF in inflammatory diseases. Nat Rev Rheumatol 2016, 12 (1), 37-48. DOI: 10.1038/nrrheum.2015.161.
